抗癌剤の副作用をアミノ酸の一種「シスチン・テアニン」 が軽減
小林 実 先生(東北大学病院総合外科・卒後研修センター助教)

演題:オキサリプラチン誘発性末梢神経障害に対するシスチンおよびテアニンの経口投与による保護効果:パイロット無作為化試験
初出:第36回 日本臨床栄養代謝学会学術集会
開催日・場所:2021年7月21日(水)〜22日(木)/神戸市(神戸ポートピアホテル)
大腸癌の実態とFOLFOX療法
世界保健機関(WHO)のデータによると、2020年の1年間に世界で新たに193万人が大腸癌を発症しています。これは乳癌、肺癌についで3番目に多く、また大腸癌による年間死亡者数は93万人であり肺癌に次いで2番目です(図1)。
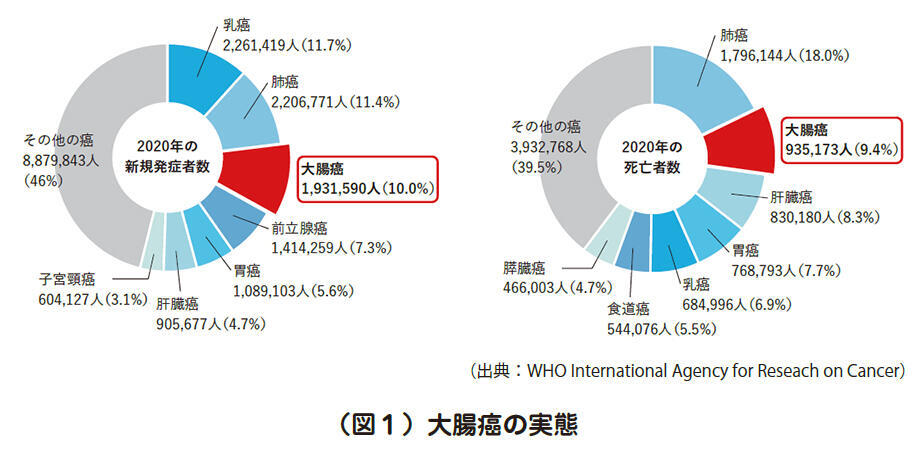
大腸癌の根治的治療は手術による切除ですが、手術不能のケースでは、化学療法や放射線療法が重要な治療手段となります。近年、化学療法は長足の進歩を遂げ、予後改善に貢献しています。
大腸癌化学療法のキードラッグの一つとして、白金製剤のオキサリプラチンが挙げられ、同剤を含む多剤併用療法「FOLFOX療法
オキサリプラチンによる末梢神経障害は、急性と慢性の二相性に起こり得ます。急性の末梢神経障害は同剤投与直後に生じ1週間ほどで改善するとされ、慢性の末梢神経障害は、同剤の投与量が800 mg/m2を超えると生じるとされています。治療効果と患者QOLの双方を維持するうえで、このようなオキサリプラチンによる末梢神経障害を予防・治療することが臨床上の課題となっており、これまでにも多くの介入が試みられてきました。しかし、確実な有効性が証明された介入法はまだ確立されていません。
※1 FOLFOX 療法:フルオロウラシル、 フォリン酸、オキサリプラチンという3種の抗癌剤を併用する化学療法
シスチン、テアニンへの期待
こうした中、グルタミン酸、システイン、グリシンがペプチド結合したトリペプチドであるグルタチオンの有用性に関する研究が複数報告されています。グルタチオンは強い抗酸化作用を有し、神経細胞を保護する働きがあるとされています。ただ、これまでの報告には有効とするものと無効とするものが混在し一定の見解が得られておらず、国内外のガイドラインで推奨されるに至っていません。
グルタチオンの前駆体であるN-アセチルシステインやグルタミンにも、化学療法による末梢神経障害の抑制効果が報告されています。これらグルタチオンの前駆体は、経静脈的でなく経口投与が可能という簡便性から、仮に有効性が証明されたとしたら臨床上のメリットは少なくないと考えられます。
今回の研究では、同じくグルタチオンの前駆体であるシスチンとテアニンに着目しています。経口摂取後にそれぞれシステインとグルタミン酸に変換され、最終的にグルタチオンが合成されます。
なお、過去には、胃癌患者に対するS-1を用いた化学療法に伴う下痢を、シスチンとテアニンが軽減することが報告されています。この効果は、化学療法によって生じる消化管でのグルタチオン減少が、シスチンとテアニンの経口摂取によって抑制されるためだと考えられています。今回の研究では、新たに大腸癌に対して化学療法施行中の患者を対象としています。
研究対象とデザイン、患者背景
対象は、2015〜2016年に仙台オープン病院でmFOLFOX6療法(FOLFOX療法の改良)を受けた大腸癌患者で、年齢は20〜80歳、パフォーマンスステータス(PS)は0(無症状で社会活動が制限されない)または1(軽度の症状があるが歩行や軽作業は可能)に該当する28名です。過去に化学療法や放射線療法の治療歴のある患者、およびコントロール不良な併存疾患のある患者は除外しています。術後補助化学療法症例と切除不能進行再発症例が含まれています。
封筒法により無作為に二群に分け、一群のみシスチン700mg/日とテアニン280mg/日を治療期間中継続して摂取しています。
主要評価項目は末梢神経障害による症状で、副次評価項目は末梢神経障害以外の有害事象の発現頻度とオキサリプラチンの総投与量としています。2週間1コースのmFOLFOX6療法を6回施行し、各コースの開始前にそれらを評価しています(図2)。
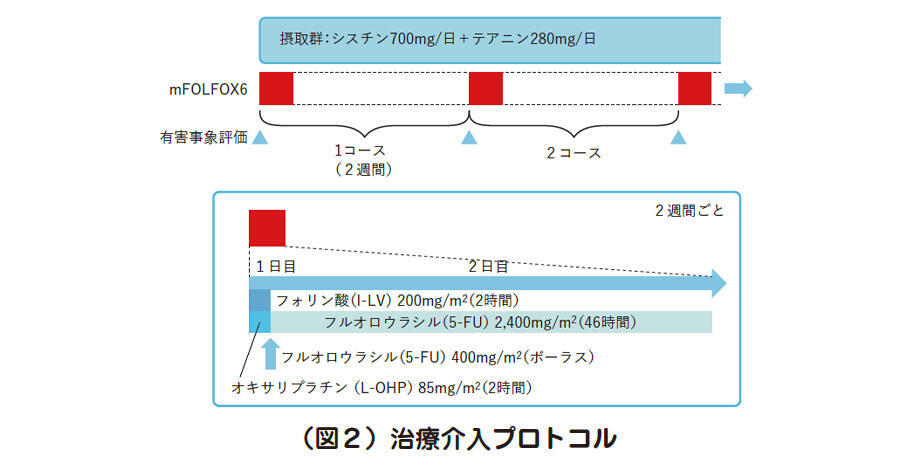
なお、末梢神経障害症状の評価には、有害事象の一般的な評価指標であるCTCAE
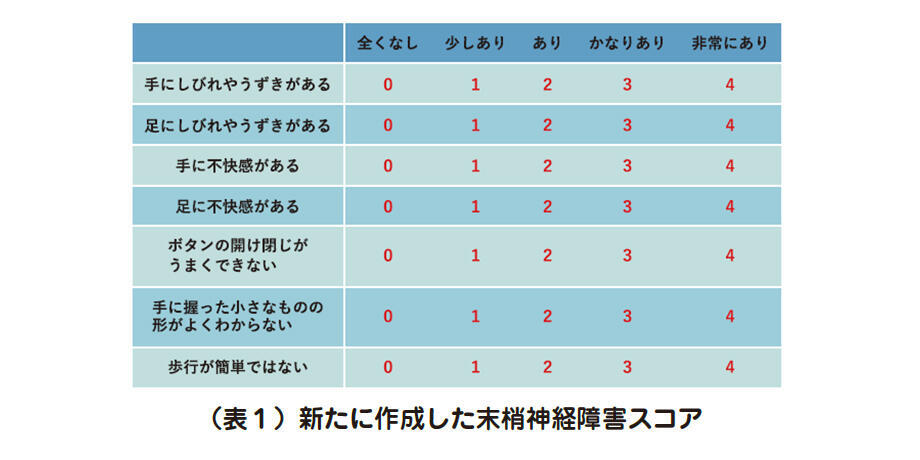
新たに作成した末梢神経障害スコアは、「手にしびれやうずきがある」「足に不快感がある」「ボタンの開け閉じがうまくできない」「手に握った小さなものの形がよくわからない」「歩行が簡単でない」などの7項目に対して0〜4点で回答してもらい、合計28点で評価します。そしてスコアが高いほど自覚症状が重症と判定します(表1)。
※2 CTCAE:Common Terminology Criteria for Adverse Events の略で、有害事象評価の ための国際的な共通基準
両群の患者背景をみると、年齢が対照群で高齢でした(58.1±2.7歳 vs 67.5±1.7歳、p<0.012)。また、有意ではないものの対照群のほうが女性の割合が高いという差がみられました(p=0.053)。その他、BMI、体表面積、大腸癌のステージ、術後補助化学療法か否か、糖尿病の既往の有無には有意差がありませんでした。
有意差のみられた年齢について、末梢神経障害スコアとの相関を検討した結果、r=0.087、p=0.660であり、結果への影響はないと考えられました。同様に、性差についても検討しましたが、結果への影響はないと考えられました。
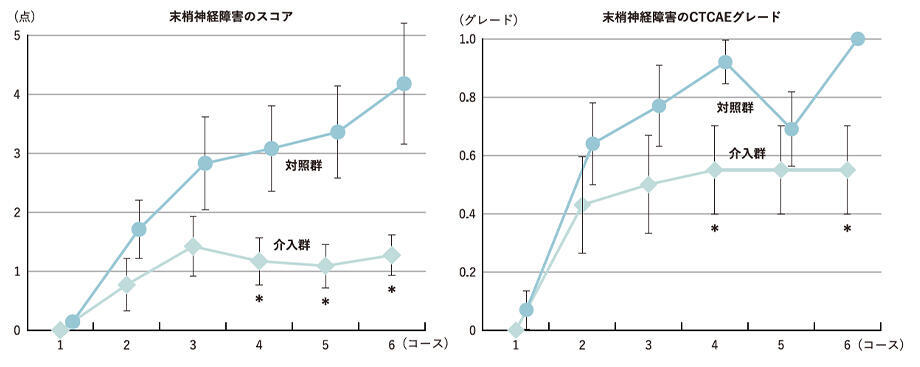
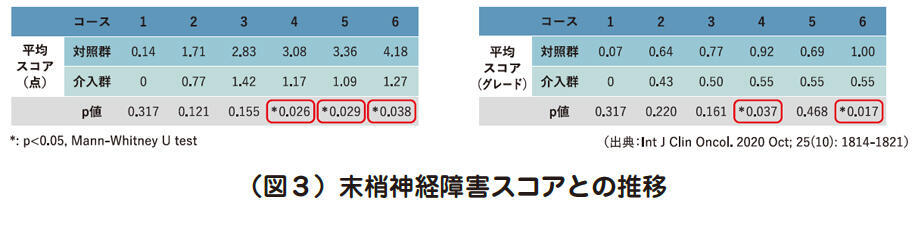
4コース目以降にスコアの有意な群間差
では結果を見てみましょう。まず主要評価項目の末梢神経障害スコアについては、3コース目までは群間差がなく、4コース目以降は介入群のほうが低く有意な群間差が認められました(図3左)。また、判定結果に差が生じにくいと予測されていたCTCAEグレードにも、4コース目と6コース目で有意差が認められました(図3右)。
副次評価項目である末梢神経障害以外の有害事象の発現頻度について有意差はありませんでした。
オキサリプラチン投与量についても、介入群で6名、対照群で7名が減量を要しましたが総投与量に有意差はありませんでした(671±52 mg vs 714±23 mg、p=0.85)。なお、両群各1名が6コースを完遂できず、一方で、中止や延期なく完遂した症例は、介入群11名、対照群12名でした(p=0.62)。
経口による連続投与が重要な可能性
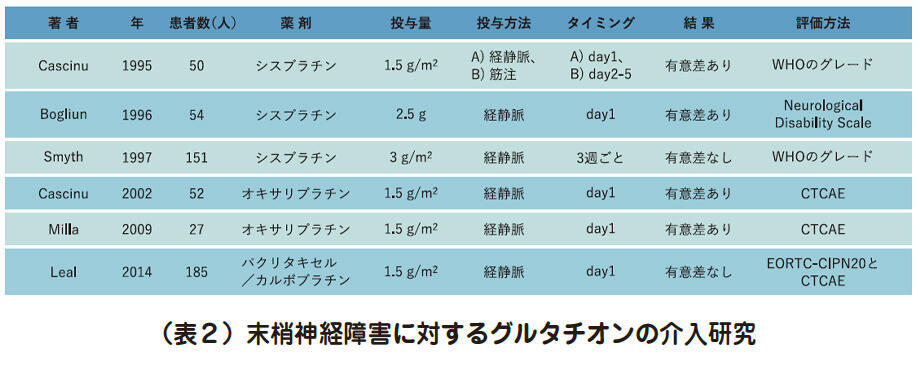
グルタチオン投与による末梢神経障害抑制を試みたこれまでの研究をみると、その大半は経静脈的に投与され、かつ、投与回数は単回です(表2)。しかし、経静脈的に投与されたグルタチオンの半減期は約11分であり、60分後には投与前値と有意差がないレベルになると報告されています
つまり、オキサリプラチンの投与後に同剤の血中濃度は長時間、高値が続いているのに対して、経静脈的に投与されたグルタチオンは、ごく短時間で作用を失うと考えられます。
これに対して、グルタチオンの前駆体であるシスチン・テアニンを連日経口摂取した場合、恒常的なグルタチオン合成が惹起され、グルタチオンの経静脈的単回投与に比較し血中濃度の高い状態が維持される可能性が想定されます。このような投与方法の違いが末梢神経障害に対する臨床効果の違いとなって現れるのではないかと考えられます。
昨年、九州大学の川尻雄大先生らが、オキサリプラチンによる末梢神経障害モデルラットに対し、シスチン・テアニンを経口摂取させるという研究結果を報告されました
なお、この実験では、シスチン・テアニン摂取によるオキサリプラチンの腫瘍縮小効果に影響がなかったとのことです。
今後の展開
本研究は探索的研究であり、多くの制約があります。まず、サンプルサイズが小さく、背景因子の一部に有意差が存在していました。また盲検化されていないためバイアスの影響を否定できません。さらに治療介入期間が限られており、オキサリプラチン総投与量は700mg前後であるため、慢性の末梢神経障害が起こり得る投与量には達していませんでした。
このような結果解釈上の留意点はあるものの、mFOLFOX6療法が施行される大腸癌患者へのシスチン・テアニンの経口摂取が、オキサリプラチンによる末梢神経障害を軽減する可能性が示され、次につながる結果であったと考えられます。今後もシスチン・テアニンの有効性に関するエビデンスの更なる構築を期待したいです。
文献
- 1) Hong S-Y, Gil H-W, Yang J-O, et al. Pharmacokinetics of glutathione and its metabolites in normal subjects. J Korean Med Sci. 2005; 20(5): 721-726.
- 2) Clinical Pharmacology and Biopharmaceutics Review. (https://www.fda.gov/files/drugs/published/N21492s008-Oxaliplatin-Clinpharm-BPCA.pdf)
- 3) Kawashiri T, Kobayashi D, Egashira N, et al. Oral administration of Cystine and Theanine ameliorates oxaliplatin-induced chronic peripheral neuropathy in rodents. Scientific Reports. 2020; 10(1): 12665.
小林 実 先生の特別インタビューはこちらをご覧ください
Profile

小林 実(こばやし みのる) 先生
東北大学病院総合外科・卒後研修センター助教
略歴
1980年生まれ、奈良県奈良市出身。信州大学医学部卒業、医学博士。2009年 みやぎ県南中核病院、2012年 東北大学肝胆膵外科・胃腸外科入局、2015年 仙台市医療センター仙台オープン病院、2018年より五戸総合病院、2020年より東北大学病院総合外科・卒後研修センター助教。
資格
日本外科学会専門医、日本消化器外科学会専門医、日本消化器病学会専門医、日本がん治療認定医機構がん治療認定医、日本臨床栄養代謝学会認定医など。
2020年10月 第58回日本癌治療学会学術集会優秀演題
2021年2月 日本臨床栄養代謝学会小越章平記念 Best Paperin The Year 2020
2021年10月 日本癌治療学会第21回研究奨励賞
